・臭覚
・pH(ペーハー)
・イオン
・解離
・平衡
・pHという環境
・溶解度
・硫化水素臭
・蔵王温泉
・硫化水素臭はどこへ消えた
・硫黄臭
化学のテキストによると、たいがい「腐卵臭」と表現されています。
しかし、これでは温泉が可哀想との思案の末に、「ゆで卵臭」と書くようにしてはいますが、実体は同じ。
硫黄泉
・単純硫黄泉
・硫黄泉(硫化水素型)
現行では上記2つに分類され、硫化水素泉は後者に属しています。
また、硫黄泉以外の泉質であっても硫化水素型と明記してある温泉もあります。
群馬と長野の県境、有名な草津温泉からさらに山を上っていくと、万座という地にお湯が湧く。軽井沢からの道路も整備され、スキーリゾートのイメージ強い万座温泉。この地に足を踏み入れると、ゆで卵が腐ったような有機的なにおいが立ち込めて、人によっては耐えられないと帰ってしまうかも知れない。
ところが、「こりゃたまらん」と病みつきになってしまう人間もいる。どちらの人種が多いのか? 統計資料はないけれど、温泉らしさをより強く感じさせてくれる後者にワタシは一票投じる。あっ、いかん。すでに何票も投じていたわ・・・。
・「大好きなお湯 お湯よし」 from わがまま温泉ランキング
・「存在を主張する強いお湯が好き」 from 秘湯入門〜温泉学事始〜
・「一度、万座温泉にでも、ご招待しなくちゃならないね」 from 松之山温泉
・「だからワタシは万座が好きだ」 from 箱根芦之湯温泉
この泉質、「酸性含硫黄-Na-硫酸塩・塩化物泉」というのであるが、旧泉質名でいくと、「酸性-硫化水素泉」となっている。ゆで卵臭の正体は硫化水素にあったのだ。
Visual 生理学・嗅覚
四大公害病の一つ、四日市ぜんそくの原因ともなったのが亜硫酸ガス。ガスというからには当然ながら気体です。この亜硫酸ガスというのは、硫黄のみならず、硫化水素が燃えても生じる物質なのです。しかも、目の粘膜がチカチカするほどの刺激臭だといいます。それに引きかえ、「ゆで卵臭」とは何と身近で、何とユーモラスな存在なのでしょう。
ところで、「ガス臭い」というと、ガス漏れを即座に思い浮かべてしまいますが、都市ガス(天然ガス)自体に匂いはなくて、危険を察知できるよう、わざと不快な匂いがつけられているんですよ。バニラエッセンスのような甘〜い匂いをつけておいたら、果たしてどうなることやら。
匂いというのは、当然ながら嗅覚器官の存する鼻腔で感知します。ということは、対象物は原則として気体でなくてはなりません。
では、ウンチは気体か? という問題に飛躍するのですが、ウンチは固体です。ときどき液体になることもありますけれど・・・。要するに、そこから発する気体成分のなかに、硫化水素ガスも含まれているということでしょう。硫化水素も期待にたがわず気体です。
しかし、同じく「硫化水素泉」とはいっても、硫化水素臭の強烈なものから、ほとんど感じられないものまで、いわば「ピンからキリ」まで多種多様。もちろん、含有量の多寡が左右していることは容易に分かるのですが、気体である硫化水素特有の事情が、そこには潜んでいそうです。
予備知識
水素イオン濃度から
pHを算出する方法
Log101=0
すなわち、水素イオン濃度1mg/Lのとき、対数値は0を示すのですから、これがpH3に相当するよう定数を3に定めます。すると、
pH=3− Log10{H+}
で求められることになりますよ!
pH(ペーハー)は溶液中の水素イオン濃度を表す指標で、正しくは「水素イオン指数」といいます。一般的には、1〜14までの数値で表示され、酸性・中性・アルカリ性といった液性を示しています。
pHによる泉質の区分も次のようになされているのでご存知ですね。
| 分類 | 強酸性泉 | 酸性泉 | 弱酸性泉 | 中性泉 | 弱アルカリ性泉 | アルカリ性泉 | |||||
| 温泉 | 玉川 | 微温湯 | 野地 | 蔦 | 鉛 | 田沢 | |||||
| pH | 2 | 3 | 6 | 7.5 | 8.5 | ||||||
| 身近な例 | 青インキ | レモン | ビール | 水道水 | 海水 | セメント | |||||
ところで、「水素イオン濃度」とは何のことでしょう。実は、温泉分析書にちゃんと載っているのです。たいていが、分析書の左側、陽イオン側の先頭部に出ているようです。「それくらい知ってる」って? 「こりゃ失礼。でも、水素イオンの数値が表す意味なんていうのは知りたいでしょ?」
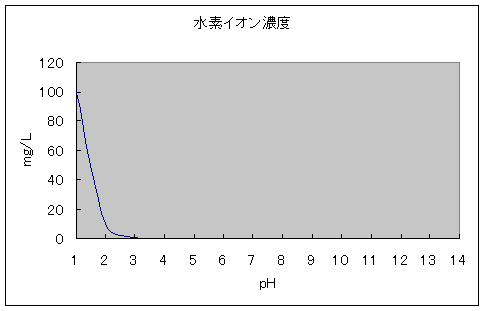
まず第一に、水素イオンが1L中に1mg以上ふくまれていれば温泉として認められます。これはご存知の方も多いですよね。では、水素イオンが1mgふくまれていれば、pHに換算すると一体いくつになるのでしょう?
| pH | mg/L |
| 1 | 100 |
| 2 | 10 |
| 3 | 1 |
| 4 | 0.1 |
| 5 | 0.01 |
| 6 | 0.001 |
| 7 | 0.0001 |
| 8 | 0.00001 |
| 9 | 0.000001 |
| 10 | 0.0000001 |
| 11 | 0.00000001 |
| 12 | 0.000000001 |
| 13 | 0.0000000001 |
| 14 | 0.00000000001 |
とあるページを書いたとき、泉質表示の段になって、デジカメに収めてきたpHの数値が読み取れなかったのです。ふと、ひらめいたのが、pH=水素イオン濃度なのだから、水素イオンの量からpHが計算できるのではないかということ。
調べてみると、「中性にあたるpH7なら1L中に1000万分の1gの水素イオンが含まれており、10倍になるごとにpH数値が変わる」とあって、これでは、未だはっきりしません。
そこで、単位をmgに変えてpH1までさかのぼってみると、右のような対応になっていることが分かりました。
● 1mg/Lというのは、pH3に相当し、「酸性泉」という分類とも、みごと一致していることにはビックリ。
● かねてより、酸性泉などという液性による分類は放射能泉同様、重量を用いた成分分析にはそぐわないと考えていました。ですが、「水素イオンという成分」に着目したものと理解すれば納得いきますね。さすが、論理的破綻のカケラも見せない温泉関連法例集。参りました!
● 2倍・3倍といった一次関数ではなく、10倍・100倍という対数になっているので含有量の違いは大きくなります。それこそ、スケールの違う世界なのです。
どれほどの違いになるか、ビックリしてもらおうとエクセルで作ったのが、次なるグラフ。pH3から先は、ほとんど無いに等しい状況です。ということは、pH8のアルカリ性泉もpH9のアルカリ性泉も、全体から見ると「目くそ、鼻くそを笑う」といった類の話になってしまいそうです。
「弱アルカリイオン水」だの「森林浴でマイナスイオン」だの、日常生活の風景においても、目にし耳にする機会が増えていますね。ここからの理解にあたっては、イオンに対するアレルギーを解消しておくことをお勧めします。
簡略な説明なら「硫酸塩泉と炭酸水素塩泉」で取り上げていますので、そちらをご覧ください。ここではたった1つだけ、注意の必要な点を追加しておきましょう。
「硫酸塩泉」という泉質の温泉はたくさんありますが、だれもがご存知となると、鳴子温泉や箱根の大湧谷温泉ということになるでのしょうか。こんなページに興味を持たれるのですから、かなりの温泉フリークと申し上げて差し支えないはずですね。きっと、鳴子温泉「滝の湯」ならば、浸かったお方も多いかも知れません。
「硫酸」というと、ねばりの強い強酸性の液体で、身体に一滴でも付着すると、直ちに水で洗い流したところで、皮膚は溶け、大火傷を負ったかのような状況に至ります。グジグジ皮膚がカサブタになり、全快までにひと月は要するという劇物です。
この「硫酸」から水素イオンが離れ、電子が余ってマイナスイオン化したものが「硫酸イオン」です。じゃあ、「硫酸イオン」って危険なんだなと、誰しも考えてしまいがち。ところが、ところが、「硫酸イオン」というのは「硫酸塩」のことなんですよ。鳴子温泉「滝の湯」で、どなたか皮膚が溶けたでしょうか? 大火傷でも負ったでしょうか?
つまり、これだけは覚えておいて欲しいのです。「名前は同じでも、イオン化すると特性は全く異なったものになる」 たとえば、字面の上では「牛肉」も「肉牛」も同じ漢字を使ってますが、似ているようで、中身は全然ちがうでしょ。同じに思えるんなら、アルゼンチンのガウチョかも・・・。
硫化水素はお湯の中では姿を変える
とんでもない珍説?
空気中とは異なって最外殻電子の回転運動が水の抵抗によって不自由になるからだろうか?
硫化水素の解離
H2S=HS-+H+
HS-=S--+H+
解離(岩波理化学辞典)
物質がその成分原子、イオン、原子団などに可逆的に分解する反応をいう。一般に高温ほど分解が進む傾向があり、水溶液中などで電解質がイオンに解離する場合をとくにイオン解離または電離という。
解離反応の平衡状態(解離平衡)に対して質量作用の法則が適用され、その平衡定数をとくに解離定数という。
たとえばイオン結合の代表格たる食塩。水に溶かすとまた元のナトリウムイオンと塩素イオンに逆戻り。なぜなんだろうと知りたくて、あれやこれやと調べてはみましたが、納得のいく説明はなし。「解離」とか「電離」とかいう反応なのだそうです。もちろん、そこからあとの解説は星の数ほどありますけれど・・・。
では、さっそく硫化水素の解離についてみていきましょう。
・お湯の中で、「硫化水素」が「硫化水素イオン」と「水素イオン」に分解される。
・さらに、さっきの「硫化水素イオン」が「硫黄イオン」と「水素イオン」に分解される。
つまりは、反応が順調に進むと、お湯の中で、
「硫化水素」が「硫黄イオン」と「水素イオン」に分解される。
このように、どんどんイオン化していく現象を正反応といいます。
| 正反応 |
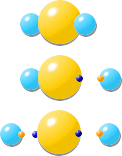 |
さすがに、文字でもうっとうしいので、右のように画像化してみました。上から順に反応が進んでいきます。
▽硫化水素
▽硫化水素イオン+水素イオン
▽硫黄イオン+水素イオン×2
ちなみに、右の色玉がそれぞれ表すものは次の通り。
・黄色の玉→硫黄(S)
・水色の玉→水素(H)
・小さな青玉→電子が過剰(マイナスイオン)
・小さな赤玉→電子が不足(プラスイオン)
ルシャトリエの法則
化学平衡で条件を変えると、その影響を打ち消す方向に移動。平衡移動の原理などとも呼ばれます。
質量作用の法則
楽しい高校化学
K1=[H+][SH-]/[H2S]
K2=[H+][S-2]/[HS-]
平衡状態にある一定温度における平衡定数は計算できます。
つまり、平衡状態にあるとき、硫化水素の解離から生じた各物質の成分比は一定とみてよいでしょう。
「平衡」といったって、別に難しいものでも何でもなくて、誰もが経験上気づいていること。科学的に厳密に説明しようとするから、教科書何ページ分にもなってしまうのです。
 もちろん、ワタシはそんな難しそうな数式なんかに興味はありません。こんな感じのことかな〜と分かる程度で十分満足。かつて、濃度については液性のところで書いたことがあるので、今回は温度を例にお話しましょう。
もちろん、ワタシはそんな難しそうな数式なんかに興味はありません。こんな感じのことかな〜と分かる程度で十分満足。かつて、濃度については液性のところで書いたことがあるので、今回は温度を例にお話しましょう。
熱湯の中に氷水を入れたビーカーを浸けておくと、熱湯側も氷水の側も、どちらも同じ温度のぬるま湯になってくれるはず。
熱い方から冷たい方へ熱の移動があったのです。そして、ビーカー中のぬるま湯の温度が突如上昇なんてことは決して起こりません。なぜなら、平衡という安定した状態に達したからです。
誰しも経験済みで納得いくでしょ? ただし、これは化学変化を伴わないので物理平衡といって、化学平衡とはちょっと違うんですけどね。
さてと、硫化水素にとっても、安定した状態を求めて解離するわけですが、お湯の例とは決定的に違う点があります。先ほどできた「ぬるま湯」が、「熱湯」と「水」に分かれることは二度とありません。こうした現象を、反応が一方通行で逆戻りできないことから不可逆反応と呼ばれています。
| 逆反応 |
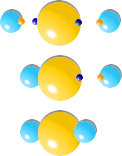 |
ところが、硫化水素の解離については、逆戻りも可能な可逆反応です。つまり、電子のキャッチボールをおこなって、姿形を変えることができるのです。
▽硫黄イオン+水素イオン×2
▽硫化水素イオン+水素イオン
▽硫化水素
このように、正反応と逆反応を同時並行的におこないつつ、硫化水素は自らが最も居やすい安定した平衡状態へと至るわけです。もう少し正確を期すと、正反応と逆反応の速さが一致して、反応が進んでないかのように見える状態が平衡です。
| 平衡移動 正反応だけが進んでいるように見える |
化学平衡 動きがないように見える |
||
| 正反応 | →→→→→ | →→→→ | →→→ |
| 逆反応 | ← | ←← | ←←← |
しかも、お湯の中の硫化水素がいかなる状態で平衡に達するかは、温度のみに依存します。濃度も圧力も関係ないというから驚きますね。
では、温度が高ければ高いほど、硫化水素はすべて水素イオンと硫黄イオンに分解されるかというと、多分そうだと言えるでしょうけど、忘れてはなりません! 解離というのは可逆反応なのですよ。つまり、温度が低くなれば、新たな平衡状態を求めて、再び硫化水素が生成されるはず。
しばし混乱「鶏と卵」
水素イオン濃度というのは原因なのか結果なのか?いわば表計算における「循環参照」というやつですね。
堂々めぐりを繰り返した末、結果に違いないという結論に。とすると、もっともっと話はややこしくなります。
そこで、今回は環境条件としてpHを設定しました。
想像イメージ
実際、調べてみると大違い。HS-の領域は、いわば、バブルのように中空に漂うはかない存在となります。
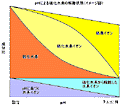
科学的論拠
電離平衡
「水素イオン指数と溶存化学種の濃度変化」という項に書いてあって、最終式を用いればなるほど納得。
しかし、スタートの和の公式が腑に落ちない。
全25湯のデータ
pHが硫化水素に及ぼす影響(別添資料)
Thanks to Mr.Yamasemi
遊離硫化水素(H2S)と硫化水素イオン(HS^-)は、別々に分析されるのではなく、全体を総H2Sとして計量してから、pH(またはH+)により計算で配分されます。
ですから、pHとH2S/HS比に相関がみられるのは当然なのであります。
実際の分析手順は、「酢酸カドミウム法」というのが一般に使われており、
1) 現地処理で温泉水に酢酸カドミウムを添加し、遊離硫化水素も硫化水素イオンもいっしょくたに硫化カドミウム(CdS)の沈殿として固定してしまいます。
2) これを試験室に持ち帰ってから、沈殿に含まれる硫黄を計量して総H2Sに換算。
3) 最後に、総H2SとpH(またはH+)から、H2S,HS-,S^2-を計算で配分します。
可逆反応に振り回されてはたまらないので、温度については、たとえば42度なら42度という適温に固定しておくことにしましょう。ワタシはちょっと熱めがいいな。
化学反応式に足を突っ込んだ途端、ワタシは塗炭の苦しみを舐めることになるのですが、「温度固定よ〜し! 泉質固定よ〜し! 水素イオン排出規制装置作動!」 それでは、水素イオンの海に「ヨーソロー」と出航しましょう。
| 酸性泉 | アルカリ性泉 |
 |
 |
解離という反応は、どんな条件でも一様に進むわけではないはずです。水素イオンが増えていくわけですから、温泉水中の水素イオン濃度(pH)によって左右されると考えるのは平衡の観点からいっても至極当然なはず。
どういうことかというと、水素イオンが多くなると、もう要らないということになってしまい、硫化水素の全部が全部、硫黄イオンと水素イオンに解離することはないはずです。
●酸性泉→水素イオンは欲しくない→解離しにくい→硫化水素が多い
●アルカリ性泉→水素イオンが欲しい→解離しやすい→硫化水素が少ない
そこで、泉質分析書ではどうなっているかと、インターネットでデータを集めてみることにしました。中性泉のデータはやたらと多く、もう要らないというくらいだったのに比し、弱酸性泉のデータがきわめて入手困難でした。
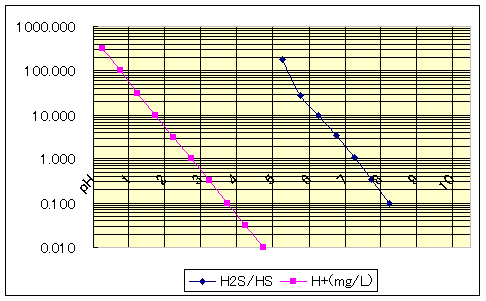
右の表は、0.5刻みのpH分類とし、最も近いpHのお湯のデータ(硫化水素・硫化水素イオン)を並べたものです。単位はいずれもmg/Lです。
| No | pH | H2S | HS- | H2S/HS- |
| 1 | 1.5 | 18.40 | 0.00 | #DIV/0! |
| 2 | 2.0 | 0.20 | 0.00 | #DIV/0! |
| 3 | 2.5 | 2.70 | 0.00 | #DIV/0! |
| 4 | 3.0 | 94.50 | 0.00 | #DIV/0! |
| 5 | 3.5 | - | - | - |
| 6 | 4.0 | - | - | - |
| 7 | 4.5 | - | - | - |
| 8 | 5.0 | 3.60 | 0.02 | 180.000 |
| 9 | 5.5 | 31.20 | 1.10 | 28.364 |
| 10 | 6.0 | 35.20 | 3.60 | 9.778 |
| 11 | 6.5 | 2.50 | 0.70 | 3.571 |
| 12 | 7.0 | 2.50 | 2.30 | 1.087 |
| 13 | 7.5 | 0.20 | 0.60 | 0.333 |
| 14 | 8.0 | 0.01 | 0.10 | 0.100 |
| 15 | 8.5 | 0.00 | 0.10 | 0.000 |
| 16 | 9.0 | 0.00 | 3.30 | 0.000 |
| 17 | 9.5 | 0.00 | 11.10 | 0.000 |
さっそくH2Sのデータに目を通すと、絶対的な重さだけに、上から順に少なくなってはくれません。泉質により硫黄成分総量に違いがあるから仕方がありません。しかし、ここで大発見。pH8.5以上だと、硫化水素は存在しません。pH8.5以上というのはアルカリ性泉、ワタシは恐ろしくなってしまいました。お上は何もかもお見通しだったのです。
続いてHS-のデータを見ると、pH3以下のいわゆる酸性泉に硫化水素イオンは存在しません。pH5になって初めてHS-が顔を出します。pH3.5〜4.5の空白域が惜しまれます。それとも、この空白域には温泉自体が少ないのでしょうか? そうだとしたら、ここで何かが起きているミステリーゾーンといえるでしょう。
まとめてみると、解離のデリケートな様相が現れるのは、pH3.5〜8までのお湯に限るといえそうです。
しかし、このままでは、pHがH2SとHS-に及ぼす影響がつかめないので、一工夫してみることにしました。まともな科学者ならばやらないでしょうが、そこは素人の気安さも手伝って、H2SとHS-の構成比を調べてみたのです。それが、表の「H2S/HS」の項目です。単位をmg/Lに限ったところが功を奏し、みごと、対数比っぽく着実に減少傾向を示しています。
グラフの対数表示というのは便利なもので、微細な変化も大きく見えて、pHと水素イオン濃度の関係だって右下がり一直線のグラフになります。pHというのは指数表示なんですから当然ですね。
さて、下のグラフは水素イオン濃度と、H2SとHS-の構成比を対数表示したものです。
水素イオン濃度と明らかな相関の見られるグラフです。データを採るにあたっては、泉温・泉質は一切気にしちゃおりませんので、どうやら、泉温よりもpHの方が解離に及ぼす影響は大きそうです。
そのワケについては立ち入りませんが、やはり科学とは楽しんでみるものですね。
硫化水素は温度によってお湯に溶けこむ量がちがう
ヘンリーの法則
気体の溶解度は低圧の場合、ヘンリーの法則によりますが、もちろん、ここでは考慮しません。
温度によって水に溶け込む分量(溶解度)が異なることは周知の事実。温めれば温めるほど、よく溶けるのです。たとえば、シロップをつくるとき、砂糖の溶け方は半端じゃないですよね。
| g/100g | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 食塩 | 35.6 | 35.8 | 36.3 | 37.1 | 38.0 | 39.3 |
| ホウ酸 | 2.8 | 4.9 | 8.9 | 14.9 | 23.5 | 38.0 |
右の表は、塩化物泉にもふくまれる食塩やホウ酸を取り上げたもの。ホウ酸の溶け方はぐんぐん増えていくことに気づきます。食塩だって変化こそ少ないものの、高温になるにつれて、溶け込む重さは増えています。しかし、この常識は、固体を水に溶かす場合の話。
| mL/mL(H2O) | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 二酸化炭素 |
1.71 |
0.88 |
0.53 |
0.36 |
- | - |
| 硫化水素 | 4.67 | 2.58 | 1.66 | 1.19 | 0.92 | 0.81 |
気体の場合は固体とは逆に、高温になればなるほど溶解度は低くなります。これは、温度が高くなると、分子の運動が活発になって、気体分子が水から飛び出すことによるのだそうです。
右の表は、炭酸泉にも含まれる二酸化炭素や、硫黄泉にも含まれる硫化水素が、1mLの水に何mL溶けるかを表したもの。確かに温度が高くなるにつれて、溶け込む量は減っています。
それなら、0℃よりもさらに冷やせばもっと溶けるかというと、残念ながら水が氷になってしまいます。しかし、溶解ということを離れると、気体の液化が始まります。たとえば、最近、環境に優しいということで、天然ガスがエネルギー源としての地位を高めていますが、その輸入にはマイナス160度の超低温まで冷却し、液化天然ガス(LNG)として輸送しています。
では、気体の溶解度が硫化水素にもたらす影響について、考えてみましょう。
 <ここより未定稿>
<ここより未定稿>平衡定数
温度による平衡定数の変化は考慮しません。
このように、気体の溶解度ということまで考えると、温泉水中の硫化水素という気体に対しては、pHという環境にプラスして、温度という縛りもかかっていることが分かりますね。
・硫化水素「存在」要因としてのpHという条件→「ない袖は振れぬ」
・硫化水素「放出」要因としての温度という条件→「泣いて馬謖を斬る」
さて、ここで、スタート地点に戻って、硫化水素臭の濃淡はなぜにあるのか? という問題に立ち返ってみましょう。もちろん、湯船の温泉水から漏れ出す硫化水素しか対象にはしていませんよ。
匂いは鼻で感じます。湯船の中に溶け込んでいられたのでは、硫化水素臭を感知できないのです。つまり、大気中にもれることが必要です。
とすると、硫化水素臭プンプンの条件として、次の2点が挙げられます。
- 温泉水中の硫化水素が多いこと
- 温泉水中に溶け込んでいられない硫化水素が多いこと
| 酸性泉 硫化水素が6つ存在 |
硫化水素 | アルカリ性泉 硫化水素が4つ存在 |
○はお湯の中に 溶解している硫化水素 ●は空気中に 放出される硫化水素 |
| ○○●●●● | 高温泉 2つだけ溶解可能 |
○○●● | |
| ○○○○●● | 低温泉 4つだけ溶解可能 |
○○○○ |
ということは、硫化水素が温泉水中から漏れ出す分量は
- 酸性度が高いほど多い
- 温度が高いほど多い
平面状にpHと温度を目盛り、その条件で漏れ出す硫化水素の量をイメージしたのが次なるグラフ。
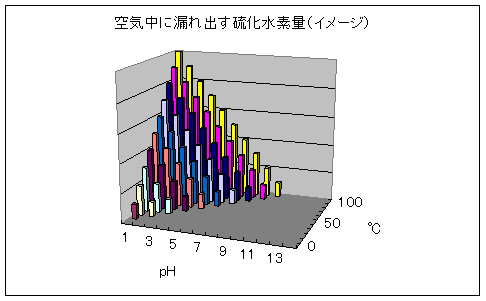
これにて、なぜに「酸性」「高温」「硫黄泉」が好きなのか、自分自身、妙に納得してしまいましたが、以上の論考はあくまで浴槽内での硫化水素の挙動。現実には、源泉湧出口から同じ反応が起こっていることでしょう。いやいや、地下に伏しているときからして、似たようなことは起きているに違いありません。
事実は小説よりも奇なり
Thanks to Mr.Honoki
HONOKI homepage
にわかに目覚めました。
お風呂の化学
お風呂の様式アラカルト
| 蔵王 | ℃ | pH | H | SO4 | HSO4 | H2S | HS | 総量 |
| 上湯 | 49.7 | 1.35 | 44.4 | 1886 | 2833 | 10.3 | − | 3487 |
| 川原湯 | 48 | 1.45 | 36.1 | 1975 | 2661 | 18.4 | − | 3720 |
ここで、ワタシを震撼させるデータが飛び込んで来ました。蔵王温泉共同浴場「上湯」と「川原湯」の泉質データです。
pHも温度もよく似た条件なので、さっそく検証に取り掛かったところ、水素イオンと硫化水素は和一定の関係なんだなと、妙にうなずいていたのも束の間、腰を抜かしてしまったのです。水素イオンの多い、つまり酸性度の高い「上湯」が、硫化水素濃度において、「川原湯」のほぼ半分という結果。しかも、硫化水素イオンはゼロ・・・。
 「事実は小説よりも奇なり」などとはよく言ったもの。感心なんかしちゃいられない!
「事実は小説よりも奇なり」などとはよく言ったもの。感心なんかしちゃいられない!
2SO2+2H2O
S+O2=SO2
 俗に「硫黄臭」とはいうものの、人によってイメージは随分ちがっているようです。一応、ワタシの話をするならば、次の二つに大別しています。ちなみに、「硝煙臭」とは花火で遊んだあとの、手につく匂いを想像してもらえれば分かると思います。
俗に「硫黄臭」とはいうものの、人によってイメージは随分ちがっているようです。一応、ワタシの話をするならば、次の二つに大別しています。ちなみに、「硝煙臭」とは花火で遊んだあとの、手につく匂いを想像してもらえれば分かると思います。
- ゆで卵臭←硫化水素
- 硝煙臭←?
「ゆで卵臭」というのが、硫化水素が原因であることは明らかですが、「硝煙臭」とはいかなる物質によるものか? 蛇足ながら、さらに論を進めます。
そういえば、こんな経験、よくお持ちでしょ? ゆで卵臭プンプンの硫化水素泉に浸かったはずなのに、お湯から上がるとそれほどでもない。しかし、二三日は硝煙臭が鼻をくすぐる。
線香花火の作り方を調べてみると、ことは簡単。そこには硫黄が含まれており、硫黄が燃焼という急激な酸化反応によって二酸化硫黄(亜硫酸ガス)に変化するのです。ということは、皮膚や下着やタオルに付着した硫黄や硫化水素が、ゆっくり酸化することにより、亜硫酸ガス様物質に変質していくということなのでしょうか。
亜硫酸ガスは気体ですから、雲散霧消するはずで、そのため「〜様物質」と名づけています。原因物質が正確には何なのか、ワタシも知りたいところです。